RESUMO
OBJETIVO: Análise da utilizaçao da matriz de regeneraçao dérmica (MRD) no tratamento de queimaduras em fase aguda e sequelas, em crianças atendidas no serviço de Cirurgia Pediátrica do Hospital Infantil Joana de Gusmao (HIJG), e avaliaçao dos resultados estéticos e funcionais com a Escala Cicatricial de Vancouver (ECV).
MÉTODO: Foram analisados todos os prontuários de crianças submetidas ao implante de MRD, no período de janeiro de 2002 a dezembro de 2010, totalizando 76 casos. No pós-operatório mínimo de um ano, os pacientes retornaram ao ambulatório de queimados do HIJG para avaliaçao dos resultados funcionais e estéticos.
RESULTADOS: A idade escolar (39,47%) e o sexo masculino (57,89%) predominaram. O álcool foi o agente agressor mais frequente (31,58%). A média da superfície corpórea queimada foi de 32,31%, prevalecendo queimaduras de espessura total (67,11%). As complicaçoes iniciais mais comuns após o implante da MRD foram hematomas (23,68%) e infecçoes (15,16%), com média de pega da matriz de 91,56%. Dentre as complicaçoes mais frequentes após o autoenxerto epidérmico, destacam-se infecçoes (10,67%), epidermólise e deslocamento (ambos com 8%). O enxerto dérmico alcançou a média de pega de 87,61%.
CONCLUSOES: Os resultados obtidos foram excelentes em 45,07% dos pacientes, com escore médio da ECV de 2 pontos, o que assegura a eficácia da MRD no tratamento de queimados.
Palavras-chave:
Queimaduras. Pele artificial. Resultado de tratamento.
ABSTRACT
PURPOSE: To analyze the use of dermal regenerate templates (DRT) in the treatment of acute burns and sequelae in the Children's Hospital Joana de Gusmao and evaluate the functional and aesthetic results according to the Vancouver Scar Scale (VSS).
METHODS: The medical files of all children submitted to DRT application from January 2002 to December 2010 were accessed, in a total of 76 cases. At least one year after the procedure, the patients returned to the hospital, to evaluate the functional and aesthetic results.
RESULTS: Most of the patients were scholars (39.47%), males (57.89%), and the liquid alcohol is the major cause of burn (31.58%). The mean total burn surface area was 32.31% and the full-thickness burns (67.11%) were the most implicated. The main complications after DRT application were hematomas (23.68%) and infections (15.16%), resulting in a mean take rate of DRT of 91.56%. Regarding the epidermal auto graft, the associated complications are infections (10.67%), epidermolysis and displacement (both with 8%). The epidermal graft achieved the average take rate of 87.61%.
CONCLUSIONS: Excellent results were obtained in 45.07%, and VSS average score was 2, which reassure the efficacy of DRT on burns treatment.
Keywords:
Burns. Skin, artificial. Treatment outcome.
As queimaduras estao entre os acidentes mais comuns na infância e representam a principal causa de óbito por acidentes domésticos em crianças abaixo de 14 anos1, além de deixarem graves sequelas funcionais e psicológicas2. Ainda hoje representam um desafio para as equipes de unidades de emergência e terapia intensiva, em decorrência da gravidade e complexidade de tratamento. Queimaduras mais extensas (com mais de 30% de superfície corpórea queimada) promovem a liberaçao local de citocinas e mediadores inflamatórios que desencadeiam uma reaçao sistêmica que cursa com aumento da permeabilidade capilar, vasoconstriçao esplâncnica e periférica, hipoperfusao de órgaos, aumento do gasto metabólico basal, reduçao da resposta imune, entre outras consequências3, levando a distúrbios hidroeletrolíticos, desnutriçao, infecçao e demais ameaças à vida4.
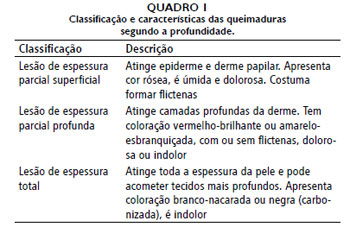
As queimaduras, atualmente, podem ser classificadas de acordo com a sua espessura em: 1) superficial, na qual somente a epiderme é acometida; 2) parcial superficial, que atinge tanto a epiderme quanto a derme papilar; 3) parcial profunda, que também afeta camadas mais profundas da derme; e 4) de espessura total, as quais atingem todas as camadas da pele, podendo até chegar a estruturas ósseas5-7. Suas características encontram-se descritas no Quadro 1.
Diversos tratamentos sao propostos para cada tipo de queimadura, levando-se em consideraçao tanto a profundidade como a superfície corporal queimada (SCQ), que em crianças é calculada através da tabela de Lund e Browder8. As queimaduras mais extensas, de espessura parcial profunda ou espessura total podem necessitar de excisao tangencial dos tecidos desvitalizados9,10 e sua cobertura5. A primeira escolha para a cobertura cutânea é o autoenxerto de pele, obtido por meio de áreas nao queimadas, entretanto, em situaçoes em que se torna necessário um tecido de melhor qualidade, mais semelhante à derme saudável, os substitutos cutâneos podem ser utilizados, de forma a regenerar uma neoderme de características histológicas semelhantes à derme normal, sobre a qual se irá assentar o enxerto epidérmico. Outra situaçao em que os substitutos cutâneos têm importante papel é nos grandes queimados, cuja área doadora é insuficiente para cobrir os locais que precisam ser excisados11.
Os substitutos cutâneos vêm sendo vastamente estudados e aprimorados ao longo dos últimos anos. Desde a sobreposiçao de aloenxertos de animais até a cultura de queratinócitos autólogos, muitos materiais foram produzidos visando à maior semelhança com a pele humana12. Segundo a nova classificaçao de substitutos de pele sugerida por Kumar13, os substitutos podem ser classificados em:
Classe I - Curativos temporários impermeáveis: nao têm nenhum componente epidérmico e sao essencialmente impermeáveis. Agem como barreira mecânica à invasao bacteriana e reduzem a perda líquida por evaporaçao;Classe II - Substitutos de pele duráveis de camada única: epidérmicos e dérmicos;Classe III - Substitutos de pele complexos, com engenharia tecidual.
O Integra
r, ou matriz de regeneraçao dérmica (MRD), é um substituto de pele complexo, permanente, de dupla camada, pertencente à classe III da classificaçao acima. A camada dérmica consiste em uma matriz de fibras de colágeno bovino e condroitina-6-sulfato, uma glicosaminoglicana derivada de cartilagem de tubarao. A camada epidérmica consiste em uma fina camada de silicone. O colágeno e a glicosaminoglicana da camada de substituiçao dérmica sao porosos e promovem a formaçao de uma neoderme, pois servem de matriz para a infiltraçao de fibroblastos, macrófagos, linfócitos e células endoteliais capilares. A camada de silicone, que substitui a epiderme, controla a perda de umidade da ferida14. Deve ser trocada por um enxerto autólogo de pele fina assim que a neoderme atingir sua maturaçao, quando adquire a coloraçao amarelo alaranjada15,16.
No serviço de cirurgia pediátrica do Hospital Infantil Joana de Gusmao (HIJG), a MRD vem sendo utilizada no tratamento de queimados desde 200217-19, e seu uso vem sendo cada vez mais ampliado, como na exérese de nevos congênitos gigantes. As indicaçoes para uso da MRD incluem áreas queimadas que necessitam de pele de melhor qualidade, como pescoço, grandes articulaçoes, maos e mamas, ou em grandes queimados submetidos à excisao tangencial sem área doadora suficiente para o enxerto autólogo.
Os resultados da utilizaçao da MRD têm se mostrado superiores20,21. Como vantagens, a MRD nao apresenta resposta imunológica22, é estéril e pode ser armazenada por longos períodos. Além disso, a técnica de implante é relativamente simples, o enxerto epidérmico é fino (menor morbidade da área doadora), apresenta resultados próximos da pele normal e acompanha o crescimento da pele. Como desvantagens há o custo elevado, a necessidade de dois procedimentos cirúrgicos e o risco de infecçao abaixo da camada de silicone.
Este estudo tem por objetivos:
1) Analisar a utilizaçao da MRD no tratamento na fase aguda e de sequelas de queimaduras em crianças atendidas no serviço de Cirurgia Pediátrica do HIJG, no período de janeiro de 2002 a dezembro de 2010;
2) Avaliar os resultados estéticos e funcionais com a Escala Cicatricial de Vancouver, a partir de pelo menos um ano da aplicaçao da MRD.
MÉTODOO estudo desenvolvido foi retrospectivo, descritivo e transversal.
Foram selecionados para o estudo 76 pacientes submetidos a tratamento cirúrgico de queimaduras utilizando MRD, no HIJG, na fase aguda ou com sequelas de queimaduras, no período compreendido entre janeiro de 2002 e dezembro de 2010, totalizando nove anos de estudo. Os prontuários foram selecionados a partir dos registros computadorizados de cirurgias do Centro Cirúrgico do HIJG e acessados através do Serviço de Arquivo Médico e Estatístico (SAME).
Após o período mínimo de um ano do implante da MRD, foram avaliados os resultados funcionais e estéticos da cirurgia, com o retorno dos pacientes ao ambulatório de queimados do HIJG.
ProcedimentosOs dados foram coletados no SAME do HIJG, e o perfil das crianças foi analisado de acordo com idade, sexo, procedência, agente agressor, profundidade da queimadura, SCQ, regiao corporal acometida e indicaçao de uso da MRD.
Em relaçao à idade, os pacientes foram distribuídos seguindo os critérios de faixa etária de Marcondes1.
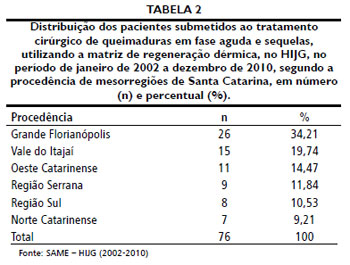
A procedência foi distribuída segundo a divisao do Estado de Santa Catarina em mesorregioes, proposta pelo Instituto Brasileiro de Geografia e Estatística (IBGE), em 2005 23.
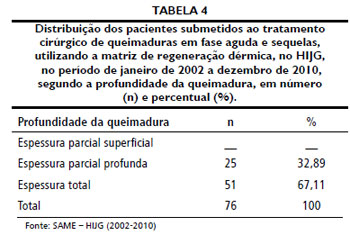
As queimaduras foram classificadas quanto à profundidade em espessura parcial superficial, parcial profunda e total (Quadro 1).
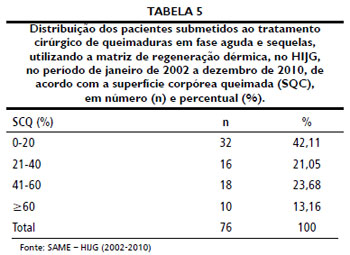
A SCQ foi analisada utilizando-se a avaliaçao proposta por Lund e Browder8, conforme rotina do atendimento inicial de pacientes vítimas de queimaduras na emergência do HIJG.
Quanto ao implante da MRD, analisou-se o tempo de maturaçao de acordo com a coloraçao no leito da lesao, que evolui de vermelho, num estágio mais precoce, até a fase madura, com coloraçao laranja-amarelada. Foram analisadas, ainda, as complicaçoes pós-operatórias e o percentual de pega por área de superfície da MRD.
A enxertia de pele, que geralmente é feita logo após a maturaçao da MRD, foi analisada de acordo com as complicaçoes iniciais e a taxa de pega por área de superfície.
A avaliaçao funcional e estética da lesao foi feita no ambulatório de queimados do HIJG, no acompanhamento pós-operatório das crianças, de acordo com a Escala Cicatricial de Vancouver (ECV)24, que varia de 0 a 13, sendo o menor escore correspondente a resultado excelente.
Após a coleta dos dados no protocolo pré-estabelecido, esses foram arquivados, compilados, catalogados e analisados utilizando-se o programa Microsoft Excel 2011, sendo feita a análise da frequência e tabulaçao cruzada das variáveis de interesse.
Este trabalho foi avaliado e aprovado pelo Comitê de Ética em Pesquisa em seres humanos do HIJG, segundo protocolo número 031/2011.
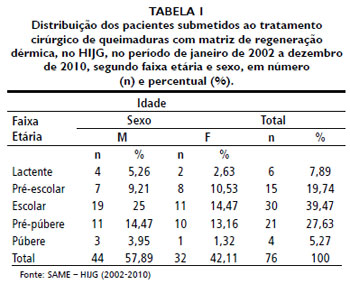
RESULTADOSOs dados epidemiológicos deste estudo sao apresentados nas Tabelas 1 e 2.
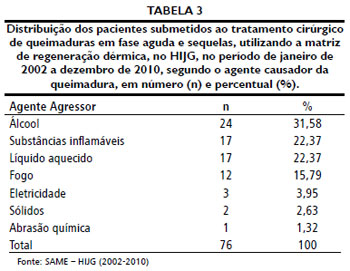
As Tabelas 3 a 5 apresentam dados referentes à queimadura, respectivamente, agente agressor, profundidade da queimadura e SCQ.
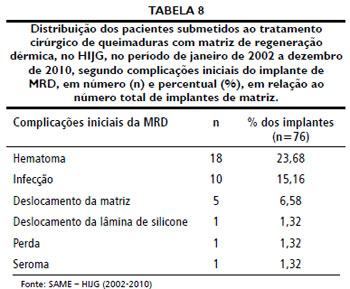
Nas Tabelas 6 a 8, estao representados dados referentes à MRD, como indicaçao do uso, local de implante e complicaçoes iniciais.
Dos 76 casos, 40 (52,63%) nao apresentaram nenhum tipo de complicaçao após o implante da matriz e 36 sofreram complicaçoes, o que corresponde a 47,37% dos implantes. Ocorreu um óbito logo após o implante da MRD, de modo que o caso foi excluído dos resultados referentes à pega da MRD, enxertia de pele e resultados pós-operatórios.
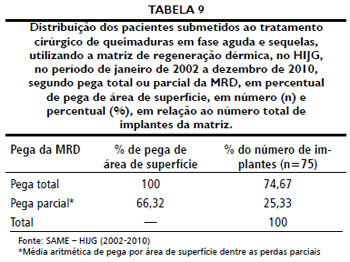
O tempo médio de maturaçao da MRD foi de 21,62 dias e a média de pega por área de superfície da matriz foi de 91,56% (Tabela 9).
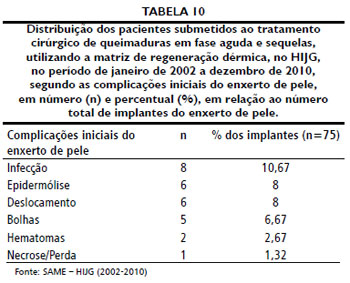
Dos 75 enxertos, 47 (62,67% dos casos) nao apresentaram nenhum tipo de complicaçao, quanto que 28 tiveram alguma intercorrência, o que corresponde a 37,33% dos casos (Tabela 10). Um óbito ocorreu logo após o enxerto de pele e o caso foi excluído dos resultados posteriores.
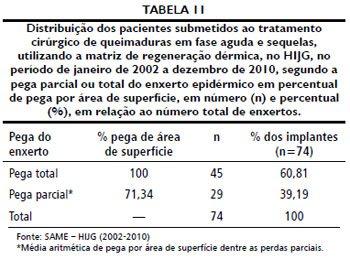
A média de pega do autoenxerto de pele foi de 87,61% por área de superfície enxertada (Tabela 11).
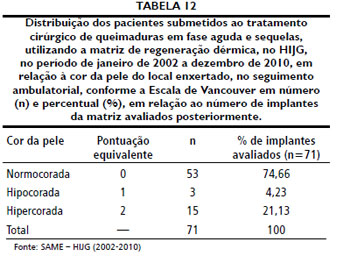
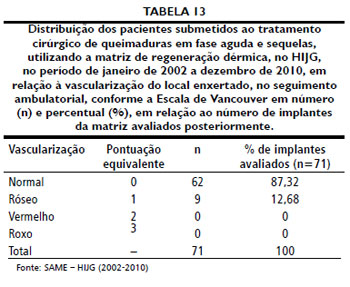
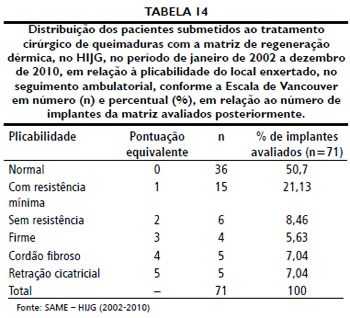
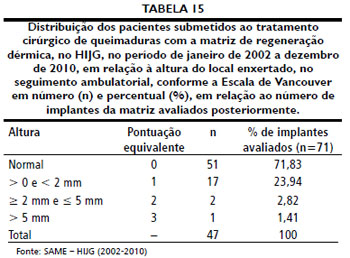
Setenta e um pacientes foram avaliados ambulatorialmente quanto aos resultados estéticos e funcionais com a Escala Cicatricial de Vancouver, após o implante de MRD, totalizando 71 implantes avaliados. Este seguimento deu-se após o tempo médio de 30,53 meses de pós-operatório, variando de 12 a 79 meses. Três pacientes nao retornaram para avaliaçao e 2 foram a óbito na fase aguda da queimadura. As Tabelas 12 a 15 sintetizam os dados obtidos após aplicaçao da Escala Cicatricial de Vancouver.
A média da Escala de Vancouver foi de 2 pontos, sendo a pontuaçao mínima encontrada no estudo igual a zero e a máxima de sete. Trinta e dois (45,07%) pacientes atingiram a pontuaçao mínima, que corresponde a um resultado excelente (Figura 1).
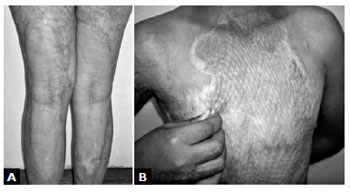
Figura 1 - A: Resultado excelente após tratamento de sequela de queimadura por inflamáveis com o implante de MRD em regioes poplíteas de ambos os membros, com 41 meses de pós-operatório. B: Resultado excelente em tórax, com plicabilidade normal, 28 meses após o implante de MRD e autoenxerto de pele expandida para tratamento de queimadura por álcool em fase aguda.
Neste estudo foram avaliadas 76 crianças submetidas ao tratamento de queimaduras com uso de MRD no HIJG, no período de janeiro de 2002 a dezembro de 2010. Após um período mínimo de 1 ano do implante da MRD, os pacientes foram reavaliados ambulatorialmente e o aspecto final do tratamento da queimadura foi classificado de acordo com a escala internacional cicatricial de Vancouver (segundo cor da pele, vascularizaçao, plicabilidade e altura do implante).
Em geral, na literatura revisada, a avaliaçao estética e funcional pós-operatória dos pacientes vítimas de queimadura se faz de maneira subjetiva, dificultando o estudo comparativo entre diferentes trabalhos. Neste estudo, optou-se por utilizar a Escala Cicatricial de Vancouver como padrao de avaliaçao, por ser um método internacionalmente utilizado e reconhecido, ser prática e de fácil uso ambulatorial e por padronizar de maneira mais objetiva os resultados encontrados, facilitando a comparaçao entre estudos. A ECV foi utilizada pela primeira vez como padrao de avaliaçao ambulatorial dos pacientes vítimas de queimadura no HIJG em um trabalho realizado em 200925, o qual serviu de base para o atual estudo, que seguiu a mesma linha de pesquisa na avaliaçao dos novos pacientes submetidos ao uso de MRD nesta unidade.
Nos estudos publicados sobre queimaduras em crianças, a idade pré-escolar (de 2 a 6 anos) é a mais prevalente26-29, e isso é atribuído ao fato de que as crianças pequenas sao totalmente dependentes de pais e cuidadores, e nao estao cientes de riscos30. No presente estudo, a idade escolar (entre 6 e 10 anos) foi a mais prevalente, com 39,47% do total (conforme Tabela 1), seguida pelos pré-púberes. A idade mais prevalente no estudo é maior que a idade relatada na literatura, pois a maioria dos pacientes pesquisados (81,58%) recebeu o implante de MRD numa fase tardia, devido a sequelas de queimaduras ocorridas anos antes. Além disso, queimaduras por álcool e inflamáveis, que foram muito prevalentes neste estudo, costumam ocorrer em crianças maiores31, constituindo outro fator para o aumento da faixa etária nesse grupo. Cinquenta e oito por cento dos pacientes sao do sexo masculino, o que condiz com a literatura, que demonstra prevalência masculina variando entre 50 a 69% dos casos26,28,29,32,33.
Os líquidos aquecidos sao os agentes causadores de queimaduras mais comuns, segundo a literatura26-30,32-34. No presente trabalho, encontrou-se como principal agente agressor o álcool líquido, correspondendo a 31,58% dos casos (Tabela 3), seguido de outras substâncias inflamáveis e líquidos aquecidos, cada um correspondendo a 22,37% das queimaduras. Tal discrepância pode ser explicada devido ao fato de que a literatura pesquisada foi majoritariamente estrangeira, e o álcool líquido nao é comercializado na maioria dos países. Em alguns artigos nacionais, como demonstra Souza et al.35, o álcool é o principal agente de queimaduras. Ainda, a alta prevalência de queimaduras por álcool neste estudo pode ser decorrente do fato das queimaduras causadas por álcool e por outros inflamáveis tenderem a ser mais profundas e extensas36, necessitando de hospitalizaçao e tratamento cirúrgico.
De acordo com a espessura, 67,11% das queimaduras foram de espessura total, e o restante, espessura parcial profunda. Como já citado, as queimaduras profundas necessitam de tratamento cirúrgico7, por isso a alta prevalência dessas no estudo.
Quanto à SCQ, 42% dos pacientes apresentaram menos de 20%, sendo que a média entre todos os pacientes foi de 32,31%. Divino Costa et al.26, num estudo de queimaduras em crianças, encontraram SCQ média de 20% em pacientes internados, enquanto Jeng et al.37 relatam que, entre pacientes submetidos ao tratamento com MRD, a média de SCQ foi de 19,5%. Forjuoh et al.30, em um trabalho de revisao de queimaduras em países subdesenvolvidos e em desenvolvimento, relataram que a maioria das queimaduras acomete menos de 10% de SCQ.
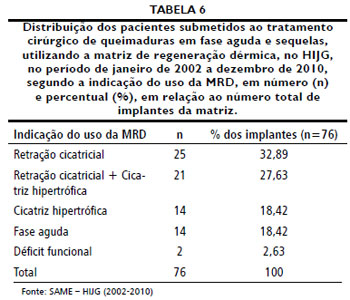
Em queimaduras de fase aguda, a MRD é indicada para o tratamento pós-excisional de queimaduras de espessura total ou parcial profunda em que nao há tecido autólogo suficiente para a cobertura, ou quando a situaçao do paciente contraindica o procedimento38. Em fase tardia, é indicada para tratamento de sequelas, como liberaçao de retraçoes cicatriciais39,40 e em cicatrizes hipertróficas14. No Serviço de Cirurgia Pediátrica do HIJG, as indicaçoes para o uso da MRD sao: em grandes queimados que nao possuem áreas doadoras suficientes e, em pequenos queimados, em áreas em que se necessita de um tecido de melhor qualidade, como pescoço, maos, pés, grandes articulaçoes e mamas. Na amostra analisada, a principal indicaçao do uso de MRD foi retraçao cicatricial, presente em 25 pacientes.
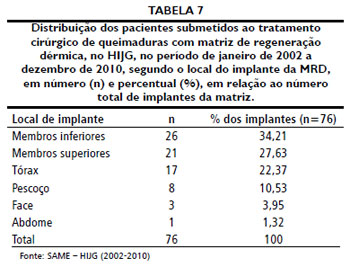
Quanto ao local do implante, os mais prevalentes foram os membros inferiores, num total de 26 implantes, seguidos de membros superiores e tórax. Forjuoh et al.30 relatam que os locais mais afetados em queimaduras sao os membros superiores, seguidos pelos membros inferiores, o que ainda está bem próximo aos resultados encontrados.
Entre as complicaçoes iniciais da MRD, os hematomas foram os mais importantes, seguidos por infecçoes, deslocamento da matriz e da lâmina de silicone. Ao todo, 36 (47,37%) pacientes apresentaram complicaçoes. Heimbach et al.41 relataram, em seu estudo, 13,2% de infecçoes superficiais e 3,1% de infecçoes invasivas, números próximos aos encontrados no presente trabalho. Dantzer e Braye39 relatam percentual de complicaçoes iniciais de apenas 23%, com hematomas em menos de 3%, infecçoes em cerca de 13% e descolamento da lâmina externa em 5%. Moiemen et al.42, em trabalho com 30 pacientes, reportam 5 (16%) casos de hematoma e nenhum caso de infecçao. Suzuki et al.43 referiram 13,5% de infecçoes nos implantes de MRD, e Frame et al.40 verificaram 20,5% de infecçoes em 127 sítios de implante, com apenas 3% de hematomas. Apesar da prevalência de infecçoes na literatura corresponder à encontrada, o percentual de hematomas neste estudo foi muito superior aos relatados nos artigos pesquisados, o que pode ser decorrente de uma incidência realmente maior em pacientes pediátricos ou da falta de padronizaçao na avaliaçao dos hematomas.
Ocorreram dois óbitos em decorrência de complicaçoes de queimaduras extensas em fase aguda, causadas por inflamáveis e fogo (incêndio), com 66,5 e 80% de SCQ, respectivamente. Um dos óbitos ocorreu após o implante de MRD, e o segundo, após o autoenxerto de pele, sendo os casos excluídos dos resultados subsequentes.
A pega total da MRD ocorreu em 74,67% dos casos. Houve pega parcial em 25,33%, sendo a média de pega por área de superfície nesses de 66,32%. No total dos casos, a média de pega por área de superfície foi de 91,56%. Entre os trabalhos revisados, a média de pega por área de superfície de MRD implantada variou de 80 e 100%40,41,44-48. Groos et al.49, em estudo com 20 implantes de MRD em crianças, encontraram perdas superiores a 50% de área de superfície implantada em 35% dos pacientes, demonstrando resultados inferiores aos encontrados. Frame et al.40 relataram que 2% dos seus pacientes sofreram perda total da matriz, percentual muito próximo aos 1,32% deste estudo.
O enxerto de pele foi realizado cerca de 21 dias após o implante da MRD, após sua maturaçao. Na literatura, há estudos demonstrando formaçao da neoderme após 14 a 21 dias41. Dantzer et al.20 reportam maturaçao da neoderme após média de 22 dias, e Frame et al.40, após 18 dias.
Quanto às complicaçoes iniciais do enxerto epidérmico, a mais comum foi infecçao, seguida por epidermólise e deslocamento. Frame et al.40 relatam 14% de infecçoes no autoenxerto epidérmico e epidermólise em 6%, valores próximos aos encontrados.
As perdas do enxerto foram maiores que as do implante de MRD, pois apenas 60,81% dos pacientes apresentaram pega total. Nos pacientes que tiveram perdas, mesmo que nao muito extensas, realizou-se novo enxerto de pele, e a taxa de pega foi obtida pela média entre o primeiro e o segundo procedimento. Por isso, a média geral de pega do autoenxerto de pele foi muito próxima à da MRD, com 87,61%. Na literatura, a média de pega do autoenxerto de pele variou entre 85% e 95% 41,43,45,46,48,50.
O tempo médio de seguimento dos pacientes foi de 30,53 meses, variando entre 12 e 79 meses. Moiemen et al.42 acompanharam os pacientes submetidos ao implante de MRD devido a sequelas de queimaduras, por um período de 3 meses a 2 anos, e relataram que a pele pode levar cerca de 18 meses para sair da coloraçao avermelhada e adquirir uma cor natural. Além disso, já foi demonstrado40 que as crianças, por apresentarem taxa de crescimento elevada, podem apresentar mais retraçoes e serem mais suscetíveis a hipertrofias cicatriciais. Desse modo, o seguimento em longo prazo é importante para obter resultados mais próximos aos definitivos e avaliar a necessidade de novas intervençoes.
Quanto à cor da pele, a maioria dos pacientes apresentou cicatrizes normocoradas (74,66%), seguidas por lesoes hipercoradas (21,13%). Palao et al.51 relataram que todas as 12 pacientes por ele avaliadas desenvolveram lesoes hipercoradas, com melhora após 12 a 18 meses a partir do implante de MRD nas mamas. A vascularizaçao nas lesoes foi normal em 87,32% dos casos. Resultados mais heterogêneos foram encontrados a respeito da plicabilidade, com 36 (50,7%) pacientes apresentando plicabilidade muito semelhante à da pele normal. A altura da lesao apresentava-se nivelada em relaçao à pele circunjacente em 71,83% dos casos, e levemente elevada em 23,94%. Queloides nao foram observados em nenhum paciente, assim como Dantzer et al.52 e Muangman et al.45 nao perceberam a formaçao de cicatrizes hipertróficas em seus pacientes.
Os resultados estéticos e funcionais do tratamento de pacientes queimados com o uso da MRD precedente ao autoenxerto de pele foram extremamente satisfatórios, com 45,07% dos pacientes apresentando pontuaçao mínima na ECV, igual a 0 (ECV varia de 0 a 13), o que representa um resultado excelente; e uma média de 2 pontos na mesma escala, ainda uma pontuaçao muito baixa, correspondente a ótimos resultados.
Tal resultado encontra respaldo na literatura, com Frame et al.40, que relataram 46% de resultados excelentes, valor muito próximo ao encontrado neste estudo. Dantzer & Baraye39 encontraram resultados bons em 76% dos casos analisados após um período médio de 2 anos. No entanto, esses autores nao usaram a ECV para avaliaçao pós-operatória; utilizaram métodos desenvolvidos por eles próprios, que avaliavam melhora funcional e coloraçao, textura e altura, respectivamente. Palao et al.51 avaliaram 12 pacientes com queimaduras em mamas, e obtiveram média pós-operatória de 2,36 pontos na ECV, variando de 1 a 5, após 12 meses da data do implante. Dantzer et al.52 analisaram resultados de queimaduras nas maos, em fase aguda e em sequelas, de 22 pacientes, após tempo médio de 12 meses. Nos pacientes com sequelas de queimaduras, a média de pontuaçao na ECV foi de 2 pontos, no pós-operatório, variando de 1 a 3. Nos pacientes submetidos ao tratamento com MRD em fase aguda, a média da ECV alcançou também o escore 3 no pós-operatório, variando de 0 a 5. Chou et al.53 referiram média de 2,5 pontos na ECV após o seguimento de 8 a 24 meses no pós-operatório. Podese perceber, portanto, que os resultados encontrados neste estudo sao semelhantes aos resultados encontrados na literatura médica.
A avaliaçao dos resultados deste trabalho e a literatura revisada permitem ter uma ideia da evoluçao do tratamento de queimados; que já conseguiu, além de reduzir em muito a mortalidade na fase aguda, também melhorar a qualidade de vida e autoestima dos pacientes em fases tardias.
CONCLUSAOA média de pega por área de superfície da MRD atingiu 91,56% e as principais complicaçoes iniciais implicadas com as perdas sao hematomas (23,68%), infecçao (15,16%), deslocamento da MRD (6,58%) e descolamento da lâmina de silicone (1,38%). O tempo médio de maturaçao é de 21,62 dias.
A média de pega por área de autoenxerto epidérmico foi de 87,61% e as complicaçoes encontradas sao: infecçao (10,67%), epidermólise (8%), deslocamento (8%) e formaçao de bolhas (6,67%).
Os resultados obtidos no seguimento ambulatorial de no mínimo um ano após o procedimento sao excelentes em 45,07% dos casos. A pontuaçao na escala cicatricial de Vancouver alcançou a média de 2 escores (variando de 0 a 7), sendo o melhor resultado igual a zero, na escala de 0 a 13.
REFERENCIAS1. Marcondes E. Pediatria básica. 9
th ed. Sao Paulo:Sarvier;2003.
2. Delgado Pardo G, Moreno García I, Marrero FR, Gómez Cía T. Psychological impact of burns on children treated in a severe burns unit. Burns. 2008;34(7):986-93.
3. Hettiaratchy S, Dziewulski P. ABC of burns: pathophysiology and types of burns. BMJ. 2004;328(7453):1427-9.
4. Fette A. Integra artificial skin in use for full-thickness burn surgery: benefits or harms on patient outcome. Technol Health Care. 2005;13(6):463-8.
5. Papini R. Management of burn injuries of various depths. BMJ. 2004;329(7458):158-60.
6. Monstrey S, Hoeksema H, Verbelen J, Pirayesh A, Blondeel P. Assessment of burn depth and burn wound healing potential. Burns. 2008;34(6):761-9.
7. Lunder C, Browder N. The estimation of areas of burns. Surg Gynecol Obstet. 1944;79:352-8.
8. Santos González CE. Guia básica para el tratamiento del paciente quemado. [Online]. Disponível em: http://www.indexer.net/quemados/clasificaciones.htm Acesso em: 20/11/2011
9. Schmitz AC. Análise da excisao tangencial no tratamento de crianças queimadas [Trabalho de conclusao de curso]. Florianópolis:Universidade Federal de Santa Catarina; 2005. 36p. Disponível em: http://www.bibliomed.ccs.ufsc.br/PE0536.pdf Acesso em: 20/11/2011
10. Orgill DP. Excision and skin grafting of thermal burns. N Engl J Med. 2009;360(9):893-901.
11. Shakespeare P. Burn wound healing and skin substitutes. Burns. 2001;27(5):517-22.
12. Centro Cochrane do Brasil. Materiais substitutivos de pele para o tratamento de queimaduras. Sao Paulo:Centro Cochrane do Brasil;2005. 91p.
13. Kumar P. Classification of skin substitutes. Burns. 2008;34(1):148-9.
14. Bloemen MC, van der Veer WM, Ulrich MM, van Zuijlen PP, Niessen FB, Middelkoop E. Prevention and curative management of hypertrophic scar formation. Burns. 2009;35(4):463-75.
15. Burke JF, Yannas IV, Quinby WC Jr, Bondoc CC, Jung WK. Successful use of a physiologically acceptable artificial skin in the treatment of extensive burn injury. Ann Surg. 1981;194(4):413-28.
16. Wood FM, Stoner ML, Fowler BV, Fear MW. The use of a non-cultured autologous cell suspension and Integra dermal regeneration template to repair full-thickness skin wounds in a porcine model: a one-step process. Burns.33(6):693-700.
17. Salvato R. Uso de matriz de regeneraçao dérmica no tratamento cirúrgico de crianças com queimaduras do Hospital Infantil Joana de Gusmao: cinco anos de experiência [Monografia]. Florianópolis:Universidade Federal de Santa Catarina;2007. 48p.
18. Perdomo H. Estudo da utilizaçao da matriz de regeneraçao dérmica em crianças com sequelas de queimaduras: estudo epidemiológico em um centro de referência no sul do Brasil [Trabalho de conclusao de curso]. Florianópolis:Universidade Federal de Santa Catarina;2004.
19. Tomita L. Uso da matriz de regeneraçao dérmica no tratamento cirúrgico de queimaduras em crianças [Monografia]. Florianópolis: Universidade Federal de Santa Catarina. Curso de Medicina; 2005. 49p.
20. Dantzer E, Queruel P, Salinier L, Palmier B, Quinot JF. Integra, a new surgical alternative for the treatment of massive burns. Clinical evaluation of acute and reconstructive surgery: 39 cases. Ann Chir Plast Esthet. 2001;46(3):173-89.
21. Branski LK, Herndon DN, Pereira C, Mlcak RP, Celis MM, Lee JO, et al. Longitudinal assessment of Integra in primary burn management: a randomized pediatric clinical trial. Crit Care Med. 2007;35(11):2615-23.
22. Michaeli D, McPherson M. Immunologic study of artificial skin used in the treatment of thermal injuries. J Burn Care Rehabil. 1990;11(1):21-6.
23. IBGE. Disponível em: http://www.ibge.gov.br/estadosat/perfil.php?sigla=sc
24. Sullivan T, Smith J, Kermode J, McIver E, Courtemanche DJ. Rating the burn scar. J Burn Care Rehabil. 1990;11(3):256-60.
25. Manara LM. Uso da matriz de regeneraçao dérmica no tratamento cirúrgico de crianças vítimas de queimaduras do Hospital Infantil Joana de Gusmao: seis anos de experiência. Florianópolis: Universidade Federal de Santa Catarina;2009. p.37.
26. Costa DM, Abrantes MM, Lamounier JA, Lemos AT. A descriptive study of burn injuries in children and adolescents. J Pediatr (Rio J). 1999;75(3):181-6.
27. Sakallioglu A, Basaran O, Tarim A, Turk E, Kut A, Haberal M. Burns in Turkish children and adolescents: nine years of experience. Burns. 2007;33(1):46-51.
28. Rawlins JM, Khan AA, Shenton AF, Sharpe DT. Epidemiology and outcome analysis of 208 children with burns attending an emergency department. Pediatr Emerg Care. 2007;23(5):289-93.
29. Asuquo ME, Ekpo R, Ngim O. A prospective study of burns trauma in children in the University of Calabar Teaching Hospital, Calabar, southsouth Nigeria. Burns. 2009;35(3):433-6.
30. Forjuoh S. Burns in low- and middle-income countries: a review of available literature on descriptive epidemiology, risk factors, treatment, and prevention. Burns. 2006;32(5):529-37.
31. Henderson P, Mc Conville H, Hohlriegel N, Fraser JF, Kimble RM. Flammable liquid burns in children. Burns. 2003;29(4):349-52.
32. Serour F, Gorenstein A, Boaz M. Characteristics of thermal burns in children admitted to an Israeli pediatric surgical ward. Isr Med Assoc J. 2008;10(4):282-6.
33. Ngim RC. Epidemiology of burns in Singapore children: an 11-year study of 2288 patients. Ann Acad Med Singapore. 1992;21(5):667-71.
34. Rossi LA, Braga EC, Barruffini RC, Carvalho EC. Childhood burn injuries: circumstances of occurrences and their prevention in Ribeirao Preto, Brazil. Burns. 1998;24(5):416-9.
35. Souza DA, Marchesan WG, Greene LJ. Epidemiological data and mortality rate of patients hospitalized with burns in Brazil. Burns. 1998;24(5):433-8.
36. Schweitzer CM. Impacto da resoluçao 46 da Anvisa sobre a incidência e gravidade de queimaduras por álcool em crianças no período de 2001 a 2006 [Trabalho de conclusao de curso]. Florianópolis:Universidade Federal de Santa Catarina;2007. p.44
37. Jeng JC, Fidler PE, Sokolich JC, Jaskille AD, Khan S, White PM, et al. Seven year's' experience with Integra as a reconstructive tool. J Burn Care Res. 2007;28(1):120-6.
38. Balasubramani M, Kumar TR, Babu M. Skin substitutes: a review. Burns. 27(5):534-44.
39. Dantzer E, Braye FM. Reconstructive surgery using an artificial dermis (Integra): results with 39 grafts. Br J Plast Surg. 2001;54(8):659-64.
40. Frame JD, Still J, Lakhel-LeCoadou A, Carstens MH, Lorenz C, Orlet H, et al. Use of dermal regeneration template in contracture release procedures: a multicenter evaluation. Plast Reconstr Surg. 2004;113(5):1330-8.
41. Heimbach DM, Warden GD, Luterman A, Jordan MH, Ozobia N, Ryan CM, et al. Multicenter postapproval clinical trial of Integra dermal regeneration template for burn treatment. J Burn Care Rehabil. 2003;24(1):42-8.
42. Moiemen NS, Vlachou E, Staiano JJ, Thawy Y, Frame JD. Reconstructive surgery with Integra dermal regeneration template: histologic study, clinical evaluation, and current practice. Plast Reconstr Surg. 2006;117(7 Suppl):160S-74S.
43. Suzuki S, Kawai K, Ashoori F, Morimoto N, Nishimura Y, Ikada Y. Longterm follow-up study of artificial dermis composed of outer silicone layer and inner collagen sponge. Br J Plast Surg. 2000;53(8):659-66.
44. Klein MB, Engrav LH, Holmes JH, Friedrich JB, Costa BA, Honari S, et al. Management of facial burns with a collagen/glycosaminoglycan skin substitute-prospective experience with 12 consecutive patients with large, deep facial burns. Burns. 2005;31(3):257-61.
45. Muangman P, Engrav LH, Heimbach DM, Harunari N, Honari S, Gibran NS, et al. Complex wound management utilizing an artificial dermal matrix. Ann Plast Surg. 2006;57(2):199-202.
46. Heimbach D, Luterman A, Burke J, Cram A, Herndon D, Hunt J, et al. Artificial dermis for major Burns: a multi-center randomized clinical trial. Ann Surg. 1988;208(3):313-20.
47. Hunt JA, Moisidis E, Haertsch P. Initial experience of Integra in the treatment of post-burn anterior cervical neck contracture. Br J Plast Surg. 2000;53(8):652-8.
48. Sheridan R, Hegarty M, Tompkins RG, Burke JF. Artificial skin in massive burns: results to ten years. Eur J Plast Surg. 1994;17(2):91-3.
49. Groos N, Guillot M, Zilliox R, Braye F. Use of an artificial dermis (Integra) for the reconstruction of extensive burn scars in children. About 22 grafts. Eur J Pediatr Surg. 2005;15(3):187-92.
50. Martinez L, Ros Z, Lopez-Gutierrez JC, Diaz M, Quezada B, Perdiguero M, et al. Integra artificial dermis in pediatric reconstructive surgery. Cir Pediatr. 2002;15(3):97-100.
51. Palao R, Gomez P, Huguet P. Burned breast reconstructive surgery with Integra dermal regeneration template. Br J Plast Surg. 2003;56(3):252-9.
52. Dantzer E, Queruel P, Salinier L, Palmier B, Quinot JF. Dermal regeneration template for deep hand burns: clinical utility for both early grafting and reconstructive surgery. Br J Plast Surg. 2003;56(8):764-74.
53. Chou TD, Chen SL, Lee TW, Chen SG, Cheng TY, Lee CH, et al. Reconstruction of burn scar of the upper extremities with artificial skin. Plast Reconstr Surg. 2001;108(2):378-84.
1. Graduanda do curso de Medicina da Universidade Federal de Santa Catarina (UFSC), Florianópolis, SC, Brasil.
2. Médica formada na Universidade Federal de Santa Catarina, residente de radiologia no Hospital Universitário Polydoro Ernani de Sao Thiago da UFSC, Florianópolis, SC, Brasil.
3. Professor do Departamento de Pediatria da UFSC, cirurgiao pediatra do Hospital Infantil Joana de Gusmao, Florianópolis, SC, Brasil.
4. Professor do Departamento de Pediatria da UFSC, cirurgiao pediatra do Hospital Infantil Joana de Gusmao e Chefe da Unidade de Queimados, Florianópolis, SC, Brasil.
Correspondência:
Maurício José Lopes Pereima
Rua Rui Barbosa, 152 - Agronômica
Florianópolis, SC, Brasil - CEP: 88025-301
E-mail: mauriciopereima@ccs.ufsc.br
Artigo recebido: 2/12/2011
Artigo aceito: 11/3/2012
Trabalho realizado na Unidade de Queimados do Hospital Infantil Joana de Gusmao, Departamento de Cirurgia Pediátrica, Florianópolis, SC, Brasil.