RESUMO
Introduçao: O tratamento de queimaduras sempre foi um desafio, tanto pela sua gravidade, como pelas múltiplas complicaçoes que normalmente ocorrem proporcionais ao tempo necessário para a cura da lesao. O laser terapêutico é uma luz monocromática e coerente que tem sido usada para induzir a cicatrizaçao de feridas indolentes. Objetivos: O estudo tem como objetivo descrever os efeitos, o mecanismo de açao e parâmetros de aplicaçao do laser terapêutico na cicatrizaçao de queimaduras. Método: Foi realizado um levantamento bibliográfico por meio de livros e publicaçoes de periódicos indexados (MEDLINE, LILACS, SciELO, Portal Periódicos da CAPES) que enfoquem o tema em questao. Resultados: Essa revisao evidencia que o laser terapêutico acelera a proliferaçao das células reparativas e aumenta a organizaçao do colágeno, porém há carência de estudos utilizando queimaduras como modelo experimental, falta de padronizaçao dos parâmetros de aplicaçao e informaçao da profundidade da lesao. Conclusao: O laser terapêutico pode ser um recurso valioso no tratamento de queimados pela sua capacidade de induzir cicatrizaçao rápida e organizada.
Palavras-chave:
Lasers. Queimaduras. Cicatrização de feridas.
ABSTRACT
Background: The treatment of burns has always been a challenge in terms of their seriousness, as the multiple complications that usually occur in proportion to the time needed to cure the lesion. The therapeutic laser is a monochromatic and coherent light that has been used to induce the healing of wounds indolent. Objectives: The study aims to describe the effects, the mechanism of action and application parameters of therapeutic laser on the healing of burns. Methods: A bibliographic survey was carried out through books and publications indexed journals (MEDLINE, LILACS, SciELO, CAPES) that address the issue in question. Results: This review shows that the laser therapy accelerates the proliferation of reparative cells and increases the organization of collagen, but there is a lack of studies using burns as an experimental model, lack of standardized criteria and application information on the depth of the lesion. Conclusion: Laser treatment can be a valuable resource in the treatment of burns by its ability to induce rapid healing and organized.
Keywords:
Lasers. Burns. Wound healing.
A queimadura é um dos traumas mais devastadores que pode atingir o homem, e considerada uma das causas frequentes de mortalidade e de graves incapacidades a longo prazo1. No Brasil, o trauma contribui com 57% do total de mortalidade na faixa etária de 0 a 19 anos e corresponde a 38% dos principais agravos atendidos no sistema de saúde2. Sabe-se que cerca de 1.000.000 de casos de queimaduras ocorrem ao ano, dos quais 100.000 pacientes procurarao atendimento hospitalar e 2.500 irao a óbito em decorrência de suas lesoes1. Estima-se uma taxa de mortalidade entre 0,86% a 34,4%, sendo que a maior parte ocorre por infecçao e o período de internaçao é, em média, de 1 a 266 dias3. Segundo Linde4, o tempo necessário para a cura da queimadura é um dos principais determinantes para o desenvolvimento de complicaçoes.
O tratamento de queimaduras sempre foi um desafio, tanto pela sua gravidade, como pela multiplicidade de complicaçoes que normalmente ocorrem. A cura da queimadura implica nao somente em cirurgias de enxertia de pele precoces, mas também em controlar e orientar a regeneraçao cicatricial, que tende a ocorrer de forma anárquica e com potencial de sequelas e infecçoes5,6.
As falhas mais importantes do reparo ocorrem em estágios iniciais, levando à diminuiçao dos elementos celulares e alteraçoes na síntese de colágeno. Diversos fatores locais e sistêmicos interferem e retardam a cicatrizaçao e, por isso, a reparaçao tecidual tem merecido atençao em vários estudos, em busca de métodos terapêuticos que possam solucionar ou minimizar as falhas no processo7.
Entre os vários recursos utilizados, o laser de baixa potência vem ganhando destaque nas últimas décadas. O laser terapêutico ou terapia por laser de baixa potência é uma forma de fototerapia que envolve a aplicaçao de luz monocromática e coerente de baixa energia em vários tipos de lesoes, obtendo sucesso quando usada para induzir a cicatrizaçao de feridas difíceis8. Seu êxito deve-se a amplos efeitos sobre os diferentes tecidos, entre os quais se destacam os efeitos trófico-regenerativos, antiinflamatórios e analgésicos, os quais têm sido demonstrados em estudos tanto in vitro como
in vivo7.
Considerando-se os agravantes mencionados e a preocupaçao de verificar a aplicabilidade clínica deste recurso, esse artigo pretende, por meio da revisao de literatura, descrever os efeitos, o mecanismo de açao, parâmetros mais adequados e possíveis benefícios do uso do laser terapêutico na cicatrizaçao de queimaduras.
QUEIMADURAS A queimadura é uma lesao dos tecidos orgânicos em decorrência de um trauma de origem térmica, que varia desde uma pequena bolha até formas graves, capazes de desencadear respostas sistêmicas proporcionais à extensao e à profundidade9. Sao lesoes que podem levar à desfiguraçao, à incapacidade e até à morte10.
Existem várias formas de classificaçao de uma lesao por queimadura, dentre elas a que se baseia na profundidade da pele prejudicada, o que determinará o tratamento e prognóstico do paciente11,12. Essas lesoes sao denominadas como superficiais (antes referidas como 1° grau), de espessura parcial (conhecidas como de 2º grau) ou de espessura total (referidas como de 3º grau)4.
As queimaduras superficiais afetam apenas a epiderme, apresentando-se hiperemiadas, edematosas e dolorosas, resolvendo-se dentro 5 a 7 dias. As queimaduras de espessura parcial podem ser superficiais ou profundas. As superficiais cicatrizam em 14 a 21 dias, acometem a derme e sua camada superior (derme papilar) apresentando bolhas, umidade e dor acentuada, deixando mínimo tecido cicatricial. As queimaduras profundas de espessura parcial acometem quase toda a espessura da derme, apresentando coloraçao pálida e menos dor. O tempo necessário para cicatrizaçao pode ser de três a seis semanas ou mais, e tais queimaduras deixarao um tecido cicatricial que pode hipertrofiar-se e contrair-se. Nas queimaduras de espessura total, a lesao acomete toda espessura da pele e, em alguns casos, se estende ao tecido subcutâneo, músculo e osso. Sao de aspecto esbranquiçado e rígido e, por nao haver elementos dérmicos para regeneraçao, só cicatrizam com enxerto4,11.
A verdadeira profundidade da queimadura pode nao ser precisa ou facilmente determinada no primeiro dia. Durante sua evoluçao, uma infecçao ou uma instabilidade hemodinâmica podem aprofundar a lesao. O próprio processo de reposiçao volêmica produz vários radicais livres que levam os danos adicionais aos tecidos13, isto permite que uma lesao de espessura parcial superficial evolua para espessura total depois de 72 h da lesao14.
PROCESSO DE CICATRIZAÇAO Quando a integridade da pele é alterada, inicia-se a cicatrizaçao, que é um processo complexo, envolvendo a interaçao entre células estromais e circulatórias que sao ativadas por um conjunto de mediadores químicos, fragmentos de células e matriz celular, microorganismos e alteraçoes físico-químicas do microambiente da lesao e áreas circunjacentes. É didaticamente dividido em três fases, interdependentes e sobrepostas dinamicamente no tempo15.
A fase inflamatória ou exsudativa inicia-se logo após a lesao, com formaçao de rede de fibrina e migraçao de neutrófilos, linfócitos e, mais tardiamente, os macrófagos, tendo como objetivo remover tecidos desvitalizados. A fase proliferativa é dividida em três subfases e é responsável pela formaçao do tecido de granulaçao. A primeira subfase é a reepitelizaçao que ocorre pela migraçao de queratinócitos das bordas e anexos remanescentes; a segunda é a fibroplasia, na qual ocorre proliferaçao de fibroblastos e produçao de colágeno, elastina e outras proteínas; a terceira é a angiogênese que ocorre paralelamente à fibroplasia, onde os novos vasos darao suporte à formaçao da nova matriz16. Nessa fase, tem início o fenômeno de contraçao realizado pelos miofibroblastos, reduzindo de 0,60 a 0,75 mm por dia a área da ferida17. A última fase é a de maturaçao ou remodelaçao, onde ocorre a substituiçao do colágeno tipo 3 pelo tipo 1, absorçao de água, diminuiçao do número de vasos, que pode levar de 6 meses a 2 anos15,16,18.
Com base na natureza da ferida e quantidade de tecido lesado, as lesoes cutâneas podem ter uma cicatrizaçao por primeira ou por segunda intençao19,20. A cicatrizaçao por primeira intençao ocorre por aproximaçao das bordas, com menor quantidade de colágeno e reduzido tempo de recuperaçao19-21. Em lesoes cutâneas por queimadura, a extensao da perda cutânea dificulta ou mesmo impossibilita a aproximaçao das bordas, ocorrendo a cicatrizaçao por segunda intençao, que é um processo mais lento, com alto risco de infecçao, produzindo retraçao cicatricial, cicatrizes extensas e alto custo de tratamento17.
Diversos fatores locais e sistêmicos podem atrasar ou impedir a cicatrizaçao, como: suporte nutricional inadequado, déficit na oxigenaçao tecidual, infecçao, necrose, ambiente seco, tamanho da ferida, idade do paciente e imunossupressao19. Qualquer alteraçao no processo de reparo leva à cicatrizaçao patológica, que pode ser agrupada de forma geral em: formaçao deficiente de tecido cicatricial, formaçao excessiva (cicatriz hipertrófica e quelóide) e a formaçao de contraturas20.
LASER TERAPEUTICO O termo laser é um acrônimo para
Light Amplification by Stimulated Emission of Radiation, que significa amplificaçao da luz por emissao estimulada da radiaçao. Embora tenha sido Albert Einstein quem concebeu os princípios da geraçao deste tipo de luz, somente em 1960 foi produzido o primeiro emissor de laser22-24.
Os primeiros lasers foram rapidamente introduzidos na Medicina, particularmente na cirurgia, utilizando-se de suas propriedades fototérmicas e fotoablativas por serem de alta potência22. Posteriormente foi possível observar efeitos nao térmicos benéficos quando aplicado em baixa intensidade23.
Os primeiros trabalhos com laser de baixa intensidade foram conduzidos pelo professor Mester1, que observou que o laser é capaz de modular processos biológicos, em particular, estimular processo de regeneraçao tecidual25.
Essa luz terapêutica corresponde a uma pequena porçao do espectro que compreende os comprimentos de onda do visível ao infravermelho próximo (330 a 1100 nm), potência menor que 500 mW e dosagens menores que 35 j/cm
2,24,26,27.
A modalidade tem encontrado crescente aplicaçao por fisioterapeutas, dentistas e acupunturistas. Os lasers utilizados por fisioterapeutas sao os de Hélio-Neônio (He-Ne), Arseneto de Gálio (AsGa), Alumínio-Gálio-Indio-Fósforo (AlGaInP) e Arseneto-Gálio-Alumínio (AsGaAl), conhecidos como lasers terapêuticos, lasers de baixa intensidade ou de baixa potência28.
Mecanismos de açao fotobiológica A efetividade do laser se deve em grande parte à sua diferença da luz ordinária em características como a monocromaticidade, coerência e colimaçao. A monocromaticidade indica que a radiaçao é constituída por fótons com um único comprimento de onda e, portanto uma só cor, esta característica determina quais biomoléculas absorverao a radiaçao incidente. A colimaçao significa que os raios sao todos paralelos, o que mantém a potência agrupada numa área pequena e percorre grandes distâncias. As depressoes e picos das ondas de luz emitidas combinam-se perfeitamente no tempo e no espaço, isto determina a coerência do laser22,23.
Segundo Low & Reed23, a colimaçao e a coerência diminuem e se perdem nos primeiros extratos da pele, nao sendo importantes para a açao biológica.
Enquanto nos lasers de alta potência os efeitos sao fototérmicos; em lasers de baixa intensidade ocorre a conversao fotoquímica da energia absorvida por fotorreceptores específicos. Os cromóforos ou fotorreceptores sao quaisquer tipos de moléculas (enzimas, membranas, substâncias) que apresentam uma configuraçao atômica capaz de ser excitada pela incidência de fótons específicos. A melanina, porfirina, hemoglobina e citocromo c oxidase sao exemplos de fotorreceptores29.
As respostas das células à radiaçao visível e infravermelha próxima ocorrem devido às mudanças físicas e químicas destes fotorreceptores que, ao absorverem a luz, assumem estado eletrônico excitado que desengatilha quatro açoes primárias:
mudanças do estado redox e aceleraçao da transferência de elétrons; alteraçoes estruturais e da atividade bioquímica pelo aquecimento transitório dos cromóforos; aumento da produçao de superóxido; geraçao de oxigênio molecular.Na sequência, os mecanismos secundários de açao consequentes às reaçoes físicas e químicas iniciadas, correspondem à transduçao do fotossinal e amplificaçao ao núcleo das células irradiadas, sendo conectadas às alteraçoes dos parâmetros da homeostasia celular (pH, Ca, AMPc, ATP e outros), que acontecem horas e até dias após irradiaçao24,29. Campos30 afirma que a açao do laser HeNe no organismo permanece por 41 dias após a aplicaçao. Isso leva a possíveis mudanças na taxa de síntese de RNA e DNA, alteraçao nas taxas de consumo de oxigênio, regulaçao do potencial de membrana e aumento da síntese de ATP24.
Para possuir este papel fotobiorregulador, o fotorreceptor deve ser estrutura chave do caminho metabólico, sendo o citocromo c oxidase - uma proteína que catalisa a etapa final do transporte de elétrons nas mitocôndrias - o principal cromóforo das células vivas29. Diversas obras demonstram que as mitocôndrias sao sensíveis à irradiaçao monocromática visível e infravermelha31,32. Campbell33 afirma que todas as células possuem citocromos, permitindo que o laser estimule todas elas. Segundo Parizzoto34, ainda existe uma outra via de açao, por meio de fotorreceptores secundários que, diferentemente do citocromo c oxidase (fotorreceptor primário), absorvem a energia por intermédio do campo eletromagnético, havendo uma espécie de ressonância desses campos com as biomoléculas, alterando cargas específicas de membranas e proteínas. Sua hipótese é que o colágeno seria um destes fotorreceptores secundários devido as suas propriedades de piezoeletricidade e piroeletricidade que consistem na geraçao de cargas elétricas quando submetido à pressao e calor, ou vice-versa, respectivamente34.
Outros autores ainda referem efeitos bioquímicos, que seriam a liberaçao de substâncias pré-formadas como histamina, serotonina e bradicinina ou até mesmo interferir na produçao de certas substâncias como prostaglandinas e endorfinas. Essa seria a explicaçao para os efeitos antiinflamatórios e analgésicos do laser terapêutico28.
Efeitos do laser terapêutico no processo de cicatrizaçao das queimaduras Há evidências na literatura que o laser terapêutico acelera a reparaçao tecidual35-39.
Dentre os protocolos experimentais utilizados, estao a cultura de células e tecidos, que referem um aumento na proliferaçao de vários tipos celulares, incluindo fibroblastos, células endoteliais e queratinócitos27,31,40.
A maioria dos estudos sobre a açao do laser no reparo tecidual foi realizada em modelos animais. Utilizando pele ou tendoes, a fotobiomodulaçao no processo cicatricial é frequentemente analisada do ponto de vista da contraçao da ferida, por meio da mensuraçao de área ou diâmetros e eventualmente outras variáveis, como estudo histológico dos vários tipos celulares, contagem de vasos e organizaçao das fibras colágenas27,34. A maior parte dos investigadores emprega o rato, que nao é o ideal, devido à pouca similaridade com a pele humana39.
Sao poucas as investigaçoes que utilizaram modelo humano, sendo conduzidas com poucos casos e de modo pobremente controlado. Entretanto, as mesmas conclusoes reportadas em estudos
in vitro e em animais sao sugeridas pelos estudos em humanos25,41.
Em seus estudos
in vivo, os pesquisadores produzem feridas cirúrgicas, tenectomias e queimaduras para serem submetidas à radiaçao laser34,38,42. As investigaçoes com queimaduras sao poucas e contraditórias, talvez pela dificuldade em padronizar as lesoes produzidas, utilizar pacientes, e diferenças do microambiente de feridas cirúrgicas e queimaduras27,42.
Alguns desses trabalhos indicam que o laser terapêutico nao acelera a cicatrizaçao de queimaduras, sugerindo que a fisiopatologia da cicatrizaçao delas é caracterizada por reaçoes inflamatórias que levam à rápida formaçao de edema e necrose do tecido, o que nao permite a fotoestimulaçao de células remanescentes42. O contrário é provado por estudos histológicos que revelam nao existir diferenças no processo de cicatrizaçao de queimaduras e outros tipos de feridas43.
A seguir, serao relacionados e comentados os principais efeitos do laser terapêutico em cada fase do processo cicatricial, relatados em artigos de revisao e em estudos experimentais com cultura de células, feridas cirúrgicas e queimaduras, relacionando-os às principais dificuldades na cicatrizaçao de queimaduras e os possíveis benefícios.
A fase inflamatória da cicatrizaçao e os efeitos da aplicaçao do laser terapêutico A inflamaçao é a fundamental para processo de reparo21. As células desta fase têm papel importante na liberaçao de enzimas e produtos de oxigênio, facilitando a limpeza dos detritos teciduais e bactérias44. Entre as condiçoes relacionadas à cicatrizaçao anormal estao a inflamaçao prolongada, o trauma repetitivo e a infecçao45.
Corazza26 observou que animais irradiados com laser na dosagem de 5 j/cm
2 apresentavam reduçao das células inflamatórias nos primeiros 3 dias, configurando uma modulaçao do processo inflamatório.
Segundo Campos30, o laser He-Ne é capaz de aumentar o número e a atividade dos polimorfonucleares sobre bactérias e promover maior fagocitose sobre os detritos teciduais. Sugere-se que a fotomodulaçao corresponde a um aumento inicial do número das células inflamatórias, removendo rapidamente o excesso de detritos e, posteriormente, a reduçao do número destas células, dinamizando a produçao de fatores de crescimento para as fases seguintes26.
Relata-se que a lesao térmica aumenta a produçao de espécies reativas de oxigênio e que atuam como fator perpetuante da resposta inflamatória13,46. Embora sejam fundamentais para sinalizaçao e ativaçao das células de reparo e da síntese protéica, a concentraçao excessiva dessas moléculas promove elevada açao inflamatória15. Na queimadura, os radicais livres sao produzidos durante a reposiçao de fluidos, e pela resposta a estímulos como bactérias e fragmentos teciduais que inicia uma sequência de fagocitoses, realizadas principalmente pelos neutrófilos, a qual é dependente de oxigênio13.
Campos30 afirma que o laser terapêutico tem efeito antioxidante, através da estimulaçao da enzima Superóxido Dismutase (SOD), principal componente antioxidante do sistema endógeno.
Karu29 relata em seus estudos que um dos possíveis mecanismos de açao do laser de baixa potência é o aumento do radical superóxido (O
2-) e peróxido de hidrogênio (H
2O
2), que conduzem a regulaçao do metabolismo celular, em equilíbrio com muitas enzimas antioxidantes. Em seus experimentos ele demonstra o efeito biomodulador do laser ao verificar que nao só a produçao do radical superóxido foi aumentada, mas também a atividade da enzima catalase (antioxidante) levando ao aumento da síntese protéica em cultura de células de levedura.
Após aplicar laser He-Ne usando a dosagem de 1J em lesoes de espessura parcial de coelhos, Araújo et al.35 observaram o desaparecimento precoce dos neutrófilos e de necrose ao 5º dia de cicatrizaçao, além de um maior número de macrófagos e discreto edema intersticial. Para Mandelbaum et al.16, o macrófago é a célula inflamatória mais importante, pois direciona a formaçao do tecido de granulaçao pela liberaçao de fatores de crescimento. A presença marcante desta célula no sítio inflamatório indica o início da fase proliferativa18. Ao analisar histologicamente as queimaduras dos ratos submetidos a laser de 670 nm, Lange et al.47 corroboram os achados de Araújo et al.35 e afirmam que o laser auxilia a formaçao e o aparecimento dos linfócitos e macrófagos, diminuindo o edema e o número de neutrófilos após algum tempo de aplicaçao.
Segundo Baum & Arpey44, o fibrinogênio presente no exsudato inflamatório converte-se em fibrina, e esta, quando em excesso, impede a migraçao dos fibroblastos e deposiçao de matriz. O acúmulo de líquido inflamatório é, portanto, indesejável, haja vista que limita a capacidade das células reparativas migrarem para dentro da ferida, aumentando o risco de infecçao48.
É atribuída ao laser terapêutico a capacidade de reduzir a intensidade do infiltrado inflamatório (edema)37,38. Paim et al.49 avaliaram a açao do laser AsGa aplicado sobre enxertos autólogos de pele em feridas carpometacarpianas de caes. Os autores observaram ocorrência reduzida de exsudato e edema, o que favoreceu uma "pega" precoce dos enxertos irradiados. Marcon & André38 concluíram que a laserterapia através de diodo AlGaIP (a 3, 6 ou 9j/cm
2 diariamente) provocou a ausência de sinais de infecçao ou inflamaçao acentuada, o que, segundo os autores, determinou a aceleraçao do processo cicatricial das feridas irradiadas em comparaçao ao grupo controle.
Sabe-se que a sepse ainda é uma das principais causas de óbito no queimado50. A literatura relata que a luz laser pode inibir o crescimento de bactérias em feridas42,51,52. Para Desimone et al.51, é necessária a fotossensibilizaçao prévia das bactérias com corantes específicos para que a irradiaçao laser provoque a destruiçao dos microorganismos. Em seu estudo, ao irradiar culturas de
Staphylococcus aureus e
Pseudomonas aerurginosa, nao previamente coradas, nao ocorreu a inibiçao do crescimento dos microorganismos nas zonas irradiadas. Por outro lado, Bayat et al.52 (2006) relatam que os mesmos microorganismos cresceram em mais de 50% das amostras obtidas de seu grupo controle, enquanto nenhuma das amostras do grupo tratado a laser apresentou as bactérias. Neste estudo, os autores nao utilizaram corantes específicos e compararam as queimaduras tratadas a laser com um grupo nao-tratado e outro exclusivamente tratado com bactericida tópico.
A fase proliferativa da cicatrizaçao e os efeitos da aplicaçao do laser terapêutico Vários estudos indicam que a luz laser promove aumento da proliferaçao fibroblástica e aceleraçao da epitelizaçao em feridas35-37,53. Ressalta-se que antissépticos como o povidine iodine, utilizados nas balneoterapias, sao potentes tóxicos aos fibroblastos e linfócitos humanos, dificultando a sua proliferaçao e migraçao durante a cicatrizaçao das queimaduras54.
Rocha Júnior et al.37 investigaram o comportamento de feridas cutâneas produzidas em ratos quando submetidas a laserterapia, observando o aumento significativo na proliferaçao fibroblástica. Araújo et al.35, em estudo semelhante conduzido em feridas de espessura parcial, corroboram os achados dos autores anteriores, onde a derme irradiada continha alto número de fibroblastos, e nestes, encontraram-se uma amostra maior de vesículas de colágeno em seu citoplasma e retículos endoplasmáticos bem desenvolvidos, indicando maior atividade em comparaçao ao grupo controle.
A reepitelizaçao e fibroplasia requer a proliferaçao e migraçao das células44. Analisando o efeito das diferentes doses do laser He- Ne sobre cultura de fibroblastos humanos, Hawkins et al.53 verificaram que as menores doses utilizadas (2,5 e 5 j/cm
2) estimularam a proliferaçao e migraçao, enquanto as altas doses (16 j/cm
2) inibiram as células. Sobre a proliferaçao e migraçao das células, Hu et al.31 utilizaram como modelo cultura de células de melanoma humano. A aplicaçao do laser He-Ne induziu um aumento na proliferaçao destas células após três dias, mas nao alterou a migraçao.
Meirelles55 comparando o efeito dos lasers de 660 nm e 780 nm em queimaduras de ratos obtiveram maior pavimentaçao epitelial em todos os grupos irradiados, afirmando ser o laser um recurso eficaz para estimular o reparo das queimaduras. Schlager et al.56, apesar de nao confirmarem a efetividade do laser terapêutico em acelerar o reparo de queimaduras, ressaltam que, macroscopicamente, a epitelizaçao do grupo irradiado demonstrou leve aceleraçao da epitelizaçao comparado ao grupo controle.
Para a eficiência da fibroplasia é necessário ocorrer a formaçao paralela dos vasos15. Em seus trabalhos pioneiros com feridas de diversas etiologias em humanos, Mester et al.25 demonstraram que o desenvolvimento dos vasos sanguíneos foi significativamente influenciado pelo laser de baixa potência. Recente estudo de Schindl et al.40 revelou aumento da proliferaçao de células endoteliais de veia umbilical humana após irradiaçao com laser diodo de 670 nm a 2 e 8 j/cm
2. Paim et al.49 e Bossini24, baseados no princípio da radiaçao laser possuir a capacidade de promover a angiogênese e aumento do fluxo sanguíneo, investigaram este recurso na viabilidade de retalhos cutâneos. Seus achados demonstraram que a terapia realmente aumentou o número de vasos e a integraçao dos retalhos cutâneos foi favorecida.
Há indicaçoes que o laser estimule a transformaçao precoce de fibroblastos em miofibroblastos8,27, o que é de grande valor para o paciente queimado, uma vez que no processo cicatricial a contraçao, devido à extensa perda tecidual, torna-se prolongada18.
Araújo et al.35, utilizando feridas cirúrgicas no dorso de ratos, analisaram o padrao histológico das feridas ao 8º, 15º e 20º dias. Observou-se que o número de miofibroblastos aumentou gradativamente no grupo controle ao longo do período analisado, enquanto na derme irradiada a populaçao de miofibroblastos foi significativamente maior no início e muito inferior no 22º dia. Os autores consideraram que as feridas irradiadas fecharam mais rapidamente devido ao aumento da contraçao promovida pelos miofibroblastos no estágio precoce da cicatrizaçao.
Alguns estudos lançaram mao da mensuraçao da área cruenta para avaliar a magnitude do processo de contraçao36,41,56,57. Hopkins et al.41 avaliaram as alteraçoes na área de feridas experimentais de humanos tratadas a laser diodo 820 nm a 8 j/cm
2. Verificaram, já no 6º dia, que as feridas irradiadas demonstraram reduçao da área 153% maior que o grupo nao-irradiado.
Segundo Lomely Mejía36, foi possível reduzir em 40% o tempo de resoluçao das feridas submetidas a terapia laser. Em contraste, Schlager et al.56,57, usando laser diodo 635, 690 e 670 nm, nao encontraram diferenças significativas mensuráveis ou visíveis quanto ao fechamento de queimaduras.
A fase de remodelaçao da cicatriz e os efeitos da aplicaçao do laser terapêutico Segundo alguns experimentos analisados, a aplicaçao precoce do laser terapêutico sobre as feridas mostrou-se capaz nao só de acelerar o fechamento das mesmas, provocando efeitos na fase inflamatória e proliferativa, mas de estimular um processo cicatricial mais harmônico e organizado, produzindo efeitos posteriores sobre o aspecto estético da cicatriz48,5-60.
Tatarunas et al.48 compararam as alteraçoes histológicas em lesoes cutâneas cirúrgicas em dois grupos de gatas após tratamento com laser AsGa a 2 e 4 j/cm
2 e em um grupo controle. As fibras colágenas mostravam maior tendência à organizaçao, orientadas paralelamente à epiderme em comparaçao ao controle. As cicatrizes das gatas irradiadas apresentaram maior resistência tênsil. É aceito que a maior organizaçao das fibras de colágeno aumenta a força tênsil da cicatriz.
Visando estudar a influência do laser de baixa intensidade sobre fibras colágenas e elásticas, Pugliese et al.58 procederam à análise das secçoes teciduais por meio dos corantes sírius vermelho, que reage especificamente com o colágeno, e orceína, para fibras elásticas. Foi revelado, durante processo cicatricial dos grupos tratados, um padrao de organizaçao mais evidente, com fibras mais unidas e, por isso, coradas de modo mais intenso e nao esparsamente distribuídas como no grupo nao tratado. O laser também contribuiu para uma discreta expressao das fibras elásticas na fase inicial.
Para uma melhor análise da participaçao das fibras colágenas na cicatrizaçao, alguns trabalhos utilizaram tendoes como modelo experimental59,60. Arruda et al.59, utilizando laser AlGaInP no tratamento de lesoes tendíneas de ratas, relatam a eficácia do laser em promover melhor grau de organizaçao das fibras colágenas ao longo do eixo longitudinal. Elwakil60 analisou histologicamente e biomecanicamente tendoes de Aquiles seccionados e, em seguida, suturados, submetidos a fotobiomodulaçao por laser HeNe. Os tendoes fotoestimulados mostraram alteraçoes fibroproliferativas bem organizadas, com faixas de colágeno adequadamente alinhadas e melhores resultados biomecânicos quanto a força, deformaçao a carga e alongamento, enquanto nos tendoes controle as bandas de colágeno mostravam-se mal alinhadas e em formas bizarras.
DOSAGEM E PARAMETROS DE IRRADIAÇAO A interaçao do laser com o tecido vivo depende do comprimento de onda, do nível de energia depositado, frequência de tratamento e estado do tecido irradiado24.
Os pesquisadores da área acreditam que as células do processo cicatricial respondem a lasers que atuam na faixa espectral vermelho, principalmente no estímulo angiogênico. Araújo et al.35, Lange et al.47, Corrêa et al.61, Carvalho et al.7, Mello et al.39 e Bossini24 confirmaram esta hipótese em seus experimentos. Em contrapartida, Bayat et al.42 (2005) e Schlager et al.56,57, ao utilizarem lasers terapêuticos para bioestimular a cicatrizaçao de queimaduras em ratos, nao observaram alteraçoes significativas no comportamento das células envolvidas no processo cicatricial e na velocidade de fechamento das lesoes.
Paim et al.49, Marcon & André38 e Rocha Júnior et al.37 relataram efeitos positivos da aplicaçao de luz infravermelha em feridas, como diminuiçao do infiltrado inflamatório, aumento da vascularizaçao e proliferaçao fibroblástica. Segundo Arruda et al.59, a radiaçao visível tem uma via mitocondrial e a invisível tem uma açao sobre cromóforos da membrana, o que os levaram a pesquisar a possibilidade de utilizar ambas as vias de estimulaçao e obter melhores efeitos. Utilizando lasers de 670 nm e 904 nm de modo individual e associado confirmou suas hipóteses observando uma organizaçao das fibras colágenas significativamente melhor nos tendoes irradiados com os dois comprimentos de onda.
Segundo Karu29, o citocromo c oxidase é o fotorreceptor chave que responde à estimulaçao de luz no espectro vermelho e infravermelho próximo. Silveira et al.32 discordam de tal afirmaçao e demonstraram, utilizando laser AsGa 904nm em lesoes cutâneas, que atividade do citocromo c oxidase responde de maneira similar à luz infravermelha.
Apesar dos relatos sobre a especificidade de absorçao das biomoléculas, verifica-se uma ampla janela biológica de absorçao de luz nos tecidos diante da aplicaçao das luzes terapêuticas, permitindo a açao biomoduladora em várias faixas do espectro com magnitudes diferentes. Como exemplo, as células sanguíneas possuem uma ampla absorçao da luz, determinando picos em algumas faixas de comprimentos de ondas, o que garante uma extensao da fotomodulaçao na janela biológica26..
Dentro de um comprimento de onda específico os efeitos sao dose-dependentes. Alguns autores acreditam que exista uma janela terapêutica para fotoestimulaçao efetiva acima de um valor limiar, porém abaixo de um valor que ocasione uma fotoinibiçao. Esse conceito é descrito como lei Arnoldt-Schultz, que prediz a existência de um efeito dose-dependente representado por uma curva fluência versus resposta biológica22,23.
A fluência recomendada para promover a reparaçao tecidual está entre 1 e 5 j/cm
2 e doses acima provocariam efeitos inibitórios ou nao satisfatórios22. A maioria dos artigos analisados seguiu este protocolo7,31,35,37,42,47,48,56,57,61. Pugliese et al.58 observaram a influência do laser AsGaAl na biomodulaçao de fibras elásticas e colágenas comparando a utilizaçao da fluências de 4 e 8 j/cm
2 e um grupo controle, os efeitos de 4 j/cm
2 sobre a deposiçao e organizaçao das fibras foi superior ao de 8j/cm
2. Tatarunas et al.48, comparando as dosagens de 2 e 4 j/cm
2 na cicatrizaçao de feridas cirúrgicas de gatas, obtiveram resultados mais vantajosos com 2 j/cm
2.
Contrariando os achados que apontavam para uma provável janela terapêutica do laser com fluência abaixo de 5j/cm
2, Hopkins et al.41 avaliaram alteraçoes em feridas de espessura parcial de humanos com laser de 820 nm utilizando 8 j/cm
2. Ao realizarem duas abrasoes de pele no mesmo membro, houve sucesso da ferida estimulada e também daquela nao irradiada. Isto fez os autores acreditarem no efeito sistêmico do laser.
Mester et al.25, em seus estudos pioneiros, já relatam que nao há necessidade de se irradiar toda a superfície da úlcera, pois a radiaçao promove efeitos em lugares distantes, por meio da liberaçao de fatores de crescimento criados no local irradiado que caem na circulaçao. Esta modalidade pode ser de grande benefício no tratamento de lesoes grandes ou de múltiplas localizaçoes como no grande queimado.
Quanto à frequência do tratamento ideal, nao se há determinaçao na literatura, de modo que existem relatos de experimentos com aplicaçao diária até aplicaçoes alternadas e únicas38,54.
Mester et al.25, ao utilizarem laser rubi para estimular crescimento de pêlo de camundongos brancos, relatam que mesmo as pequenas doses cumulativas, aplicadas de maneira repetitiva induzem a inibiçao. A dosagem 1 j/cm
2, quando utilizada por 3 a 5 semanas, levou ao crescimento dos pêlos, mas após a décima primeira semana inibiu o crescimento dos mesmos.
Confirmando os efeitos de doses altas x doses baixas, Hawkins & Abrahamse53 demonstraram que cultura de fibroblastos humanos expostas a doses cumulativas de 2,5 ou 5 j/cm
2 durante três dias determinou aumento da proliferaçao e migraçao, e as culturas expostas por três dias à fluência de 16 j/cm
2 foram inibidas.
A magnitude da fotobioestimulaçao também depende do estado fisiológico da célula e momento da aplicaçao. Karu29 observou que células com pH menor que o normal, onde o estado redox tende para uma direçao reduzida, sao consideradas mais sensíveis à açao estimulante da luz do que aquelas com parâmetros ótimos ou próximo do normal. Todos os artigos analisados iniciaram a laserterapia imediatamente após a lesao ou com até 48 horas.
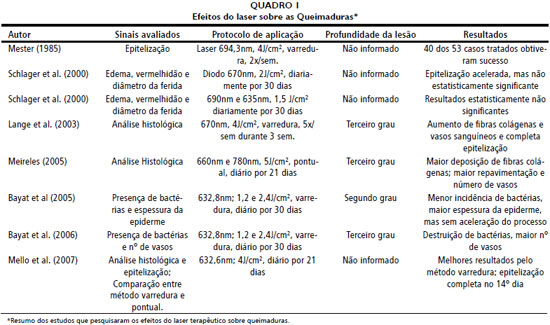
ESTUDOS SOBRE A LASERTERAPIA NA CICATRIZAÇAO DE QUEIMADURASDentre os 26 artigos experimentais analisados, 8 avaliaram os efeitos do laser sobre a cicatrizaçao de queimaduras (Quadro 1).
Lange et al.47, em seu experimento, testaram os efeitos do laser AlGaInP a 4 j/cm
2 no modo varredura, em queimaduras de terceiro grau, observando na análise histológica, sete dias após a lesao, a presença de fibrina hemática neutrófica, linfócitos, neutrófilos e fibroblastos jovens, enquanto no grupo nao tratado apresentava fibrina hemática neutrófica em maior quantidade, secreçao purulenta, menor número de capilares e fibroblastos.
Mello et al.39 (2007) confirmam os efeitos positivos da irradiaçao com o laser terapêutico, observando que as queimaduras do seu grupo experimental tratadas pelo método varredura estavam cicatrizadas ao 14° dia, enquanto que as do grupo experimental tratadas pelo método pontual e as do grupo controle nao estavam cicatrizadas.
Meirelles55 comparou, por meio da microscopia de luz, o efeito dos comprimentos de onda 660 nm e 780 nm no reparo de queimaduras de terceiro grau, em ratos diabéticos e nao diabéticos. Os resultados mostraram maior deposiçao de fibras colágenas, tecido de granulaçao, maior repavimentaçao epitelial e maior número de vasos em todos os grupos irradiados, principalmente quando utilizou 780 nm nos nao diabéticos e 660 nm diabéticos.
Por causa dos resultados animadores obtidos em seus estudos piloto, em 1971, Mester et al.25 começaram a utilizar o laser no tratamento de vários tipos de feridas em humanos. Os estudos foram iniciados com laser ruby e, mais tarde, HeNe e Argônio a 4j/cm
2, 2 vezes por semana. Dos 53 casos de queimaduras tratados, 40 obtiveram sucesso.
Bayat et al.52 utilizaram laser HeNe com densidade energética de 1,2 e 2,4 j/cm
2 no tratamento de queimaduras de ratos, comparado a grupos exclusivamente tratados com bactericida tópico e nao tratados. Observou que as queimaduras de terceiro grau tratadas a 2,4j/cm
2 nao apresentaram
S. aureus e
P. aeruginosa, e histologicamente mostraram um maior número de vasos em ambos os grupos irradiados.
Em estudo anterior, Bayat et al.42 utilizaram em queimaduras de segundo grau, os mesmos parâmetros de aplicaçao e critérios de investigaçao. Os resultados foram semelhantes quanto ao efeito bactericida e contagem de vasos, mas concluíram que o laser nao acelerou a cicatrizaçao de queimaduras, pois todos os grupos cicatrizaram no mesmo intervalo de tempo.
Schlager et al.57 usaram laser 670 nm, 250 mW a 2 j/cm
2 e em outro estudo, esse mesmo grupo56 empregou dois diferentes lasers com 635nm e 690nm, e densidade de energia de 2j/cm
2 em ambos os casos, 30 e 12mW de potência, respectivamente. Em ambos estudos, duas queimaduras foram infligidas em cada rato e apenas uma foi irradiada e sua evoluçao cicatricial analisada macroscopicamente por meio de edema, vermelhidao e epitelizaçao. Segundo o autor, nao foram observadas diferenças visíveis ou mensuráveis entre os grupos.
A diversidade entre os resultados pode estar ligada à falta de padronizaçao dos parâmetros e da frequência de tratamento. Além disso, a profundidade da queimadura é de grande importância clínica, pois determina a conduta e o sucesso da cicatrizaçao11. Schlager et al.56,57, Mello et al.39, Mester et al.25 nao informaram a profundidade das queimaduras. Lange et al.47, Bayat et al.52 e Meireles55 informaram que produziram queimaduras de terceiro grau em seus animais.
Sabe-se que queimaduras de terceiro grau dificilmente cicatrizam sem enxertos e queimaduras de segundo grau profundo têm aparência muito semelhante às de terceiro grau62. Segundo Linde4, mesmo cirurgioes experientes se confundem ao classificar as queimaduras no primeiro momento.
Apenas Bayat et al.42 utilizaram queimaduras de segundo grau em seu experimento.
CONSIDERAÇOES FINAIS A partir dos achados descritos, observa-se que o laser terapêutico é capaz de promover um processo cicatricial mais rápido e de melhor qualidade. A maioria dos estudos revela que a laserterapia acelerou a proliferaçao de células, aumentou a vascularizaçao e melhorou a organizaçao do colágeno. Entretanto, poucos exploraram os efeitos do laser na cicatrizaçao de queimaduras e mostraram achados divergentes.
Foi verificada uma diversidade de parâmetros de aplicaçao, além de alguns autores nao informarem a profundidade da queimadura. Talvez a falta de padronizaçao dos protocolos e da identificaçao da profundidade das lesoes seja o motivo de resultados contraditórios.
É importante intervir precocemente no processo cicatricial do paciente queimado, a fim de evitar complicaçoes inerentes de uma hospitalizaçao prolongada, diminuir o comprometimento estético e funcional. Diante dessa necessidade, das vantagens atribuídas ao laser e da carência de experimentos com queimaduras, sugere-se que mais estudos busquem os efeitos do laser terapêutico sobre a pele queimada, por meio de protocolos mais padronizados, com critérios de avaliaçao e inclusao rigorosos e utilizem modelos humanos ou animais com tegumento semelhante.
REFERENCIAS 1. Gomes DR, Serra MC, Macieira L. Queimaduras no Brasil. In: Condutas atuais em queimaduras. Rio de Janeiro:Revinter;2001. p.1-3.
2. Brasil. Ministério da Saúde. Seminário discute uso do álcool gel para prevenir queimaduras. Disponível em: http;www.portal.saude.gov.br/portal/aplicaçoes/noticias/noticias_detalhe.cfm?co_seq_noticia=7032 Acesso em 6 de maio de 2008.
3. Pires RAJ. Análise de 781 crianças com queimaduras internadas no Hospital Infantil Joana Gusmao - Florianópolis-SC [Monografia]. Florianópolis:Curso de Graduaçao em Medicina, UFSC;2003. 41p.
4. Linde LG. Reabilitaçao de crianças com queimaduras. In: Tecklin JP, ed. Fisioterapia pediátrica. 3ª ed. Porto Alegre:Artmed;2002. p.384-422.
5. Ferreira SR. O grande queimado: uma abordagem fisioterapêutica [Monografia]. Goiânia: Graduaçao em Fisioterapia, Universidade Católica de Goiás;2003. 162p.
6. Crisóstomo MR, Serra MC, Gomes DR. Epidemiologia das queimaduras. In: Maciel E, Serra MC, eds. Tratado de queimaduras. 1ª ed. Sao Paulo: Atheneu;2004. p.31-5.
7. Carvalho PTC, Siqueira JFR, Ferreira JVL, Silva IS. Análise de fibras colágenas através da morfometria computadorizada em feridas cutâneas de ratos submetidos a irradiaçao do laser HeNe. Fisioter Bras. 2003;4(4):253-8.
8. Hawkins D, Houreld N, Abrahamse H. Low level laser therapy (LLLT) as an effective therapeutic modality for delayed wound healing. Ann N Y Acad Sci. 2005;1056:486-93.
9. Guirro E, Guirro R. Queimaduras. In: Fisioterapia dermato-funcional: fundamentos, recurso e patologias. Sao Paulo:Manole;2004. p.491-7.
10. Silveira JMS, Gomes DR, Serra MC. Atendimento pré-hospitalar. In: Maciel E, Serra MC, eds. Tratado de queimaduras. 1ª ed. Sao Paulo:Atheneu;2004. p.51-63.
11. Johson RM, Richard R. Partial-thickness burn: identification and management. Adv Skin Wound Care. 2003;16(4):178-87.
12. Watts AM, Tyler MP, Perry ME, Roberts AH, McGrouther DA. Burn depth and its histological measurement. Burns. 2001;27(2):154-60.
13. Barbosa E, Moreira EAM, Faintuch J, Pereima MJ. Suplementaçao de antioxidantes: enfoque em queimados. Rev Nutr. 2007;20(6):693-702.
14. Gomes DR. Fisiologia e fisiopatologia. In: Gomes DR, Serra MC, Pellon MA. Tratamento de queimaduras: um guia prático. Rio de Janeiro:Revinter;1998. p. 8-17.
15. Balbino CA, Pereira LM, Curi R. Mecanismos envolvidos na cicatrizaçao: uma revisao. Rev Bras Cienc Farm. 2005;41(1):27-51.
16. Mandelbaum SH, DiSantis EP, Mandelbaum MHS. Cicatrizaçao: conceitos atuais e recursos auxiliares-Parte I. An Bras Dermatol. 2003;78(4):393- 410.
17. Coelho COM, Rezende CMF, Tenório APM. Contraçao de feridas após cobertura com substitutos temporários de pele. Ciência Rural. 1999;29(2):297-303.
18. Piccolo MTS, Piccolo NS, Piccolo MS. O processo de cicatrizaçao. In: Serra MC, Maciel E, eds. Tratado de queimaduras. Rio de Janeiro:Atheneu;2004. p.583-94.
19. Hess CT. Tratamento de feridas e úlceras. 4ª ed. Rio de Janeiro: Reichmann & Affonso;2002.
20. Robbins SL, Cotran RS, Kumar V, Abbas AK, Fausto N. Tecido de renovaçao e reparaçao: regeneraçao, cicatrizaçao e fibrose. In: Robbins e Cotran. Patologia: bases patológicas das doenças. 7ª ed. Rio de Janeiro: Elsevier;2005. p.91-124.
21. Guirro ECO, Guirro RRJ. Cicatriz hipertrófica e quelóide. In: Fisioterapia dermato-funcional: fundamentos, recursos, patologias. 3ª ed. Barueri:Manole;2002. p.413-24.
22. Baxter D. Laserterapia de baixa intensidade. In: Kitchen S, ed. Eletroterapia: prática baseada em evidências. 11ª ed. Barueri: Manole;2003. p.171-88.
23. Low J, Reed A. Laserterapia. In: Eletroterapia explicada: princípios e prática. Sao Paulo:Manole;2001. p.389-409.
24. Bossini PS. Laser de baixa intensidade (670nm) na viabilidade do retalho cutâneo randômico em ratos [Dissertaçao de Mestrado]. Sao Carlos:Programa de Pós-Graduaçao Interunidades em Bioengenharia (Escola de Engenharia de Sao Carlos, Faculdade de Medicina de Ribeirao Preto, Instituto de Química de Sao Carlos), Universidade de Sao Paulo;2007. 132p.
25. Mester E, Mester A, Mester A. The biomedical effects of laser application. Lasers Surg Med. 1985;5(1):31-9.
26. Corazza AV. Fotobiomodulaçao comparativa entre Laser e LED de baixa intensidade na angiogênese de feridas cutâneas em ratos [Dissertaçao de Mestrado]. Sao Carlos: Programa de Pós-Graduaçao Interunidades em Bioengenharia (Escola de Engenharia de Sao Carlos, Faculdade de Medicina de Ribeirao Preto, Instituto de Química de Sao Carlos), Universidade de Sao Paulo;2005. 89p.
27. Posten W, Wrone DA, Dover JS, Arndt KA, Silapunt S, Alam M. Low level laser therapy for wound healing: mechanism and efficacy. Dermatol Surg. 2005;31(3):334-40.
28. Guirro ECO, Guirro RRJ. Laser. In: Fisioterapia Dermato-funcional: fundamentos, recursos, patologias. 3ª ed. Barueri:Manole;2002. p.209-22.
29. Karu T. Primary and secondary mechanisms of action of visible to near-IR radiation on cells. J Photochem Photobiol B. 1999;49(1):1-17.
30. Campos S. Laserterapia HeNe. [S.L.] 2004. 9p. Disponível em
Acesso em: 7 de maio 2008.
31. Hu WP, Wang JJ, Yu CL, Lan CC, Chen GS, Yu HS. Helium-neon laser irradiation stimulates cell proliferation through photostimulatory effects in mitochondria. J Invest Dermatol. 2007;127(8):2048-57.
32. Silveira PC, Streck EL, Pinho RA. Evaluation of mitocondrial respiratory chain activity in wound healing by low level laser therapy. J Photochem Photobiol B. 2007;86(3):279-82.
33. Campbell MK. Fosforilaçao oxidativa. In: Bioquímica. 3ª ed. Porto Alegre: Artmed;2003. p 520-43.
34. Parizotto NA. Açao do laser de Hélio-Neônio sobre o processo de reparo tecidual: um estudo do colágeno por microscopia eletrônica de varredura, microscopia eletrônica de força atômica e espectroscopia por infravermelho [Tese de Doutorado]. Campinas:Faculdade de Engenharia Elétrica, UNICAMP;1998. 196p.
35. Araújo CEN, Ribeiro MS, Favaro R, Zezell DM, Zorn TMT. Ultrastructural and autoradiographical analysis show a faster skin repair in He-Ne lasertreated wounds. J Photochem Photobiol B. 2007;86:87-96.
36. Lomely Mejìa PA, Lecona Butròn H, Montiel Hernandez AM, Rosillo Ruiz A, Garcìa Lopez ES. Reducción del tiempo de cicatrización por medio de laser de helio-neón. Modelo experimental en conejos. Rev Mex Ortop Traum. 1999;13(5):455-8.
37. Rocha Junior AM, Oliveira RG, Farias RE, Andrade LCR, Aarestrup FM. Modulaçao da proliferaçao fibroblástica e da resposta inflamatória pela terapia a laser de baixa intensidade no processo de reparo tecidual. An Bras Dermatol. 2006;81(2):150-6.
38. Marcon K, André ES. Efeitos do laser GaAlInP no processo de cicatrizaçao de feridas induzidas em ratos. Rev Fisioter FURB. 2005;1(1):1-7.
39. Mello PB, Sampedro RMF, Piccinini AM. Efeitos do laser HeNe e do modo de aplicaçao no processo de cicatrizaçao de queimaduras em ratos. Fisioter Pesqui. 2007;14(2):6-13.
40. Schindl A, Merwald H, Schindl L, Kaun C, Wojta J. Direct stimulatory effect of low intensity 670nm laser irradiation on human endothelial cell proliferation. Br J Dermatol. 2003;148(2):334-6.
41. Hopkins JT, McLoda TA, Seegmiller JG, Baxter GD. Low level laser therapy facilitate superficial wound healing in humans: a triple- blind, shamcontrolled study. J Athl Train. 2004;39(3):223-9.
42. Bayat M, Vasheghani MM, Razavi N, Taheri S, Rakhshan M. Effect of low level laser therapy on the healing of second- degree burns in rats: a histological and microbiological study. J Photochem Photobiol B. 2005;78(2):171-7.
43. Vorauer-Uhl K, Fürnschlief E, Wagner A, Ferko B, Katinger H. Reepithelialization of experimental scalds effected by topically applied superoxide dismutase: controlled animal studies. Wound Repair Regen. 2002;10(6):366-71.
44. Baum CL, Arpey CJ. Normal cutaneous wound healing: clinical correlation with cellular and molecular events. Dermatol Surg. 2005;31(6):674-86.
45. Sobral MC. Efeitos do silicone gel no tratamento da cicatriz hipertrófica e do quelóide pós-queimadura: uma revisao bibliográfica [Monografia de Graduaçao em Fisioterapia]. Recife: Universidade Federal de Pernambuco; 2008. 27p.
46. Jaskille AD, Jeng JC, Sokolich JC, Lunsford P, Jordan MH. Repetitive ischemia-reperfusion injury: a plausible mechanism for documented clinical burn- depth progression after thermal injury. J Burn Care Res. 2007;28(1):13-20.
47. Lange F, Kroth A, Steffani JA, Lorencetti N. Influência da laserterapia no processo cicatricial de queimaduras de terceiro grau. Fisioter Bras. 2003;4(5):335-40.
48. Tatarunas AC, Matera JM, Dagli MLZ. Estudo clínico e anatomopatológico da cicatrizaçao cutânea no gato doméstico. Utilizaçao do laser de baixa potência GaAs (904nm). Acta Cir Bras. 1998;13(2):86-93.
49. Paim CBV, Raiser AG, Cardoso E, Beck C. Enxerto autólogo de pele, em malha, com espessura completa, na reparaçao de feridas carpometacarpianas de caes. Resposta à irradiaçao laser. Ciência Rural. 2002;32(3):451-7.
50. Macedo JLS, Rosa SC, Macedo KCS, Castro C. Fatores de risco da sepse em pacientes queimados. Rev Col Bras Cir. 2005;32(4):173-7.
51. Desimone NA, Christiansen C, Dore D. Bactericidal effect of 0.95-mW helium-neon and 5-mW indium-gallium-aluminum-phosphate laser irradiation at exposure times of 30, 60, and 120 seconds on photosensitized Staphylococcus aureus and Pseudomonas aeruginosa in vitro. Phys Ther. 1999;79(9):839-46.
52. Bayat M, Vashighani MM, Razavi N. Effect of low level helium-neon laser therapy on the healing of third-degree burns in rats. J Photochem Photobiol B. 2006;83(2):87-93.
53. Hawkins D, Abrahamse H. Effect of multiple exposures of low level laser therapy on the cellular responses of wounded human skin fibroblasts. Photomed Laser Surg. 2006;24(6):705-14.
54. Gonçalves G, Parizotto NA. Fisiopatologia da reparaçao cutânea: atuaçao da Fisioterapia. Rev Bras Fisioter. 1998;3(1):5-13.
55. Meirelles GCS. Análise comparativa do efeito dos lasers GaAlAs de λ = 660nm λ + 780nm na cicatrizaçao de úlceras por queimaduras em dorso de ratos diabéticos e nao-diabéticos: estudo histológico [Tese de Doutorado]. Salvador:Faculdade de Odontologia, UFBA; 2005. 120p.
56. Schlager A, Oehler K, Huebner KU, Schmuth M, Spoetl L. Healing of burns after treatment with 670 nanometer low power laser light. Plast Reconstr Surg. 2000;105(5):1635-9.
57. Schlager A, Kronberger P, Petschke F, Ulmer H. Low power laser light in the healing of burns: a comparison between two different wavelengths (635nm and 690nm) and placebo group. Lasers Surg Med. 2000;27(1):39-42.
58. Pugliese LS, Medrado AP, Reis SRA, Andrade ZA. The influence of low level laser therapy on biomodulation of collagen and elastic fibers. Pesqui Odontol Bras. 2003;17(4):307-13.
59. Arruda ERB, Rodrigues NC, Taeiro C, Parizotto NA. Influência de diferentes comprimentos de onda da laserterapia de baixa intensidade na regeneraçao tendínea do rato após tenectomia. Rev Bras Fisioter. 2007;11(4):283-8.
60. Elwakil TF. An in-vivo experimental evaluation of He-Ne laser photostimulation in healing Achilles tendons. Lasers Med Sci. 2007;22(1):53-9.
61. Corrêa FI, Prado FS, Miranda CM, Souza ARG, Corrêa JCF. O uso do He-Ne (632,8nm) no fechamento de feridas. Fisioter Bras. 2003;4(2):144-7.
62. Serra MC, Gomes DR, Crisóstomo MR. Cálculo da área queimada e indicadores para internaçao hospitalar. In: Maciel E, Serra MC, eds. Tratado de Queimaduras. 1ª ed. Sao Paulo:Atheneu;2004. p.43-9.
1. Fisioterapeuta formada pela Universidade Federal de Pernambuco; Residente em Saúde Coletiva pelo CPqAM- Fiocruz-Pernambuco.
2. Fisioterapeuta do Centro de Terapia de Queimados - Hospital da Restauraçao/PE; Professora do Curso de Fisioterapia da UNICAP.
3. Fisioterapeuta do Centro de Terapia de Queimados - Hospital da Restauraçao/PE; Especialista em Anatomia do Aparelho Locomotor.
Correspondência:
Alexsandra Gomes de Andrade
Rua Victor José Fernandes, 482 - Bairro Novo
Olinda, PE - CEP: 53030-090
E-mail: xandinhag@hotmail.com
Recebido em: 15/1/2010
Aceito em: 5/3/2010
Trabalho realizado no Centro de Terapia de Queimados - Hospital da Restauraçao, Recife, PE.